PAI-1驱动的SFRP2高表达癌症相关成纤维细胞劫持放射免疫治疗的远端效应
摘要:
放射免疫治疗中的远端效应(即照射区域外肿瘤消退现象)虽具治疗潜力但临床发生率极低,其机制尚未明晰。本研究通过体内全基因组CRISPR筛选,鉴定出分泌型卷曲相关蛋白2(SFRP2)是调控远端效应的潜在基质因子。研究发现,SFRP2在未照射肿瘤中呈现癌症相关成纤维细胞(CAFs)特异性表达,并在放射免疫治疗干预后显著上调。特异性敲除CAFs中的Sfrp2基因可通过重塑血管-免疫微环境,促进CD8+ T细胞向未照射肿瘤的浸润,从而增强远端效应。体内谱系追踪显示,SFRP2的升高与放射免疫治疗驱动的周细胞谱系定向分化密切相关。血清蛋白质组学分析表明,受照射肿瘤分泌的血浆纤溶酶原激活物抑制剂-1(PAI-1)通过LRP1/p65信号轴,触发远隔肿瘤周细胞发生命运转变,分化为SFRP2高表达CAFs。药理学阻断SFRP2或PAI-1可显著增强人源化患者来源异种移植(PDX)模型中的远端效应。本研究表明,PAI-1诱导的SFRP2high CAFs是劫持远隔效应的关键基质调控因子,为提升放射免疫治疗效果提供了潜在治疗靶点。
研究背景:
放疗(RT)在多种癌症的临床治疗中仍具有关键作用,常被用于靶向局部或寡转移病灶。放疗还能通过刺激"远端效应"(一种针对未照射远处转移灶的肿瘤特异性免疫反应,可引发其消退)展现出更广泛的系统性抗肿瘤能力。此外,该特性可通过使原本对治疗无反应的肿瘤对传统药物疗法敏感,从而增强免疫检查点抑制剂(ICI)的疗效。尽管放疗联合免疫治疗(即放射免疫治疗)前景广阔,但远端效应在真实临床场景中发生率仍较低(0-34.3%)。
自Robin Moles于1953年首次提出该概念以来,学界已开展诸多尝试以增强远隔效应,包括:提高肿瘤免疫原性、增强肿瘤引流淋巴结(TDLNs)中的T细胞启动、对远隔肿瘤实施低剂量照射以及系统性激活抗肿瘤巨噬细胞等。然而,目前研究主要集中于假设验证层面,特定作用靶点仍未得到充分探索。此外,临床前研究成果向临床观察的转化仍存在显著障碍,这种转化存在不一致性,可能源于现有肿瘤模型无法精准模拟人体生物学特性。
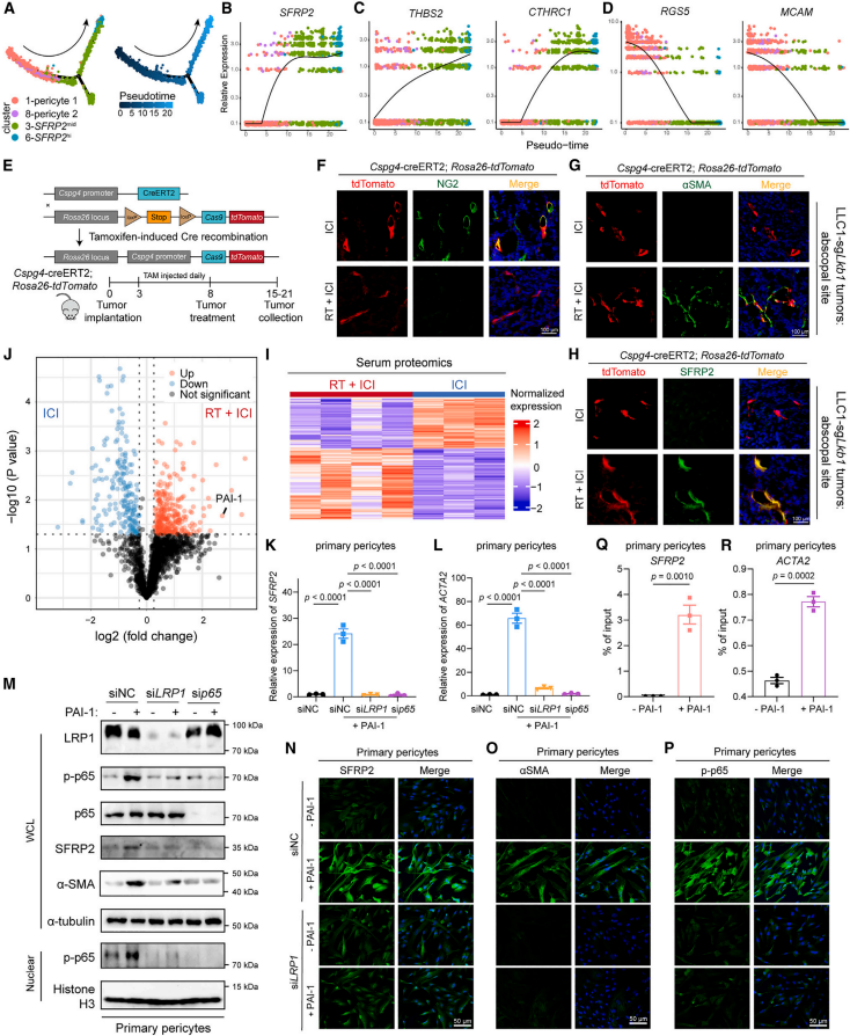
本研究通过CRISPR全基因组编辑技术开展正向遗传筛选,系统解析了远端效应特异性遗传易感因素。研究发现,高表达分泌型卷曲相关蛋白2(SFRP2high)的癌症相关成纤维细胞(CAFs)通过重塑血管周围免疫抑制微环境主导远端效应,从而阻碍CD8+ T细胞向未照射肿瘤的浸润。更重要的是,受照射肿瘤释放的血浆纤溶酶原激活物抑制剂-1(PAI-1)经血液循环迁移至远端肿瘤部位,诱导周细胞-成纤维细胞转分化(PFT),进而生成SFRP2high CAFs。在人源化患者来源异种移植(PDX)模型中,阻断SFRP2信号级联反应可成功触发放射免疫治疗的远端效应。
研究成果:
1. 通过全基因组CRISPR筛选,发现SFRP2是调控CAFs活化的关键基因。SFRP2高癌相关成纤维细胞(CAFs)通过重塑血管周围免疫抑制微环境,抑制 CD8+ T细胞浸润,从而阻碍远端效应。
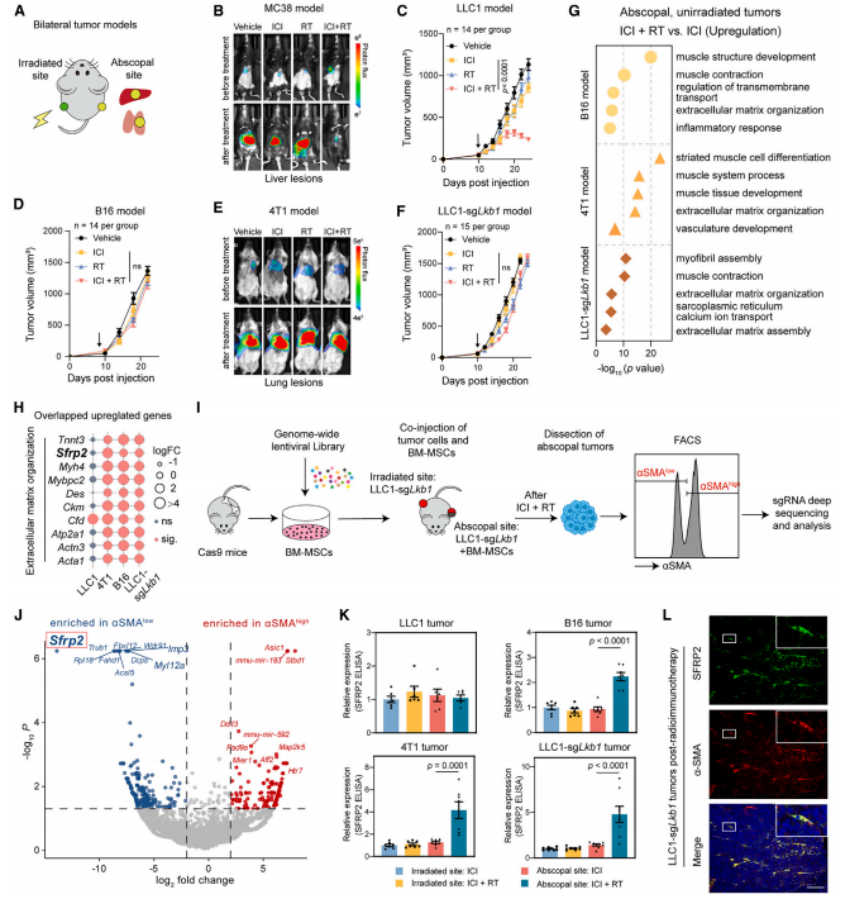

2.基因敲除或药物阻断 SFRP2,可显著增强 CD8+ T细胞招募,来改变血管周围的免疫抑制微环境,从而促进远端效应。
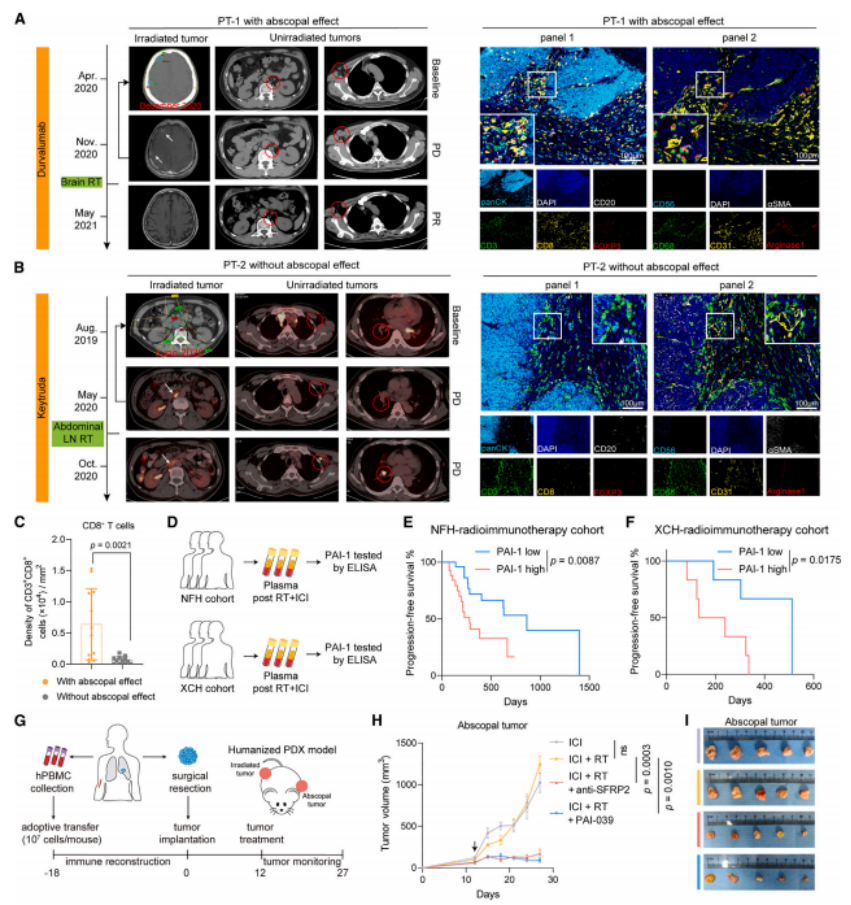

3.通过血清蛋白质组学发现,放疗后照射部位肿瘤分泌PAI-1,通过血液到达远端肿瘤,激活LRP1/p65通路,驱动周细胞向SFRP2high CAFs转化(周细胞-成纤维细胞转化,PFT)。SFRP2high CAFs形成血管周围免疫抑制微环境,抑制CD8+ T细胞招募。

4.分析24例接受放疗联合ICI治疗的肺癌患者组,发现基线CD8+ T细胞浸润与远端效应正相关。人源化PDX模型验证SFRP2中和抗体或PAI-1抑制剂可逆转 CAF 的免疫抑制功能,显著增强放射免疫治疗的远端效应,验证了该发现的临床转化潜力。


研究结论:
该研究揭示了放疗诱导的PAI-1/SFRP2轴通过重塑CAFs抑制远隔效应的新机制,提出了靶向间质微环境的联合治疗策略,该研究还表明了基线 CD8+ T细胞浸润水平和 PAI-1 表达可作为预测远端效应的潜在标志物,为改善免疫治疗效果提供了新靶点和新思路。
新闻推荐
在线咨询
Online consultation

关注微信公众号


