外泌体研究|从形成机制到前沿应用,一文带你全攻略!
Part.1 外泌体的形成和结构
1.什么是外泌体
外泌体(Exosome)是一种由不同类型细胞脱落释放的大小均一、直径为30-150nm的脂质双层膜结构囊泡。它可以在血液、尿液、唾液、脑脊液、关节液、支气管肺泡灌洗液等。外泌体形态通常为杯状结构,密度为1.13~1.19g/ml,携带多种蛋白质、脂质、lncRNA、circRNA、miRNA,参与细胞通讯、细胞迁移、血管新生、免疫反应和肿瘤细胞生长等过程。
2.外泌体的形成机制和特征
外泌体的形成是通过细胞质膜的内吞作用,内陷形成了早期内涵体(early-sorting endosome,ESE),而ESEs可以成熟为晚期内涵体,产生多囊泡体multivesicular endosomes,(MVBs),多囊泡体外膜与细胞质膜融合后,向细胞外释放出外泌体。
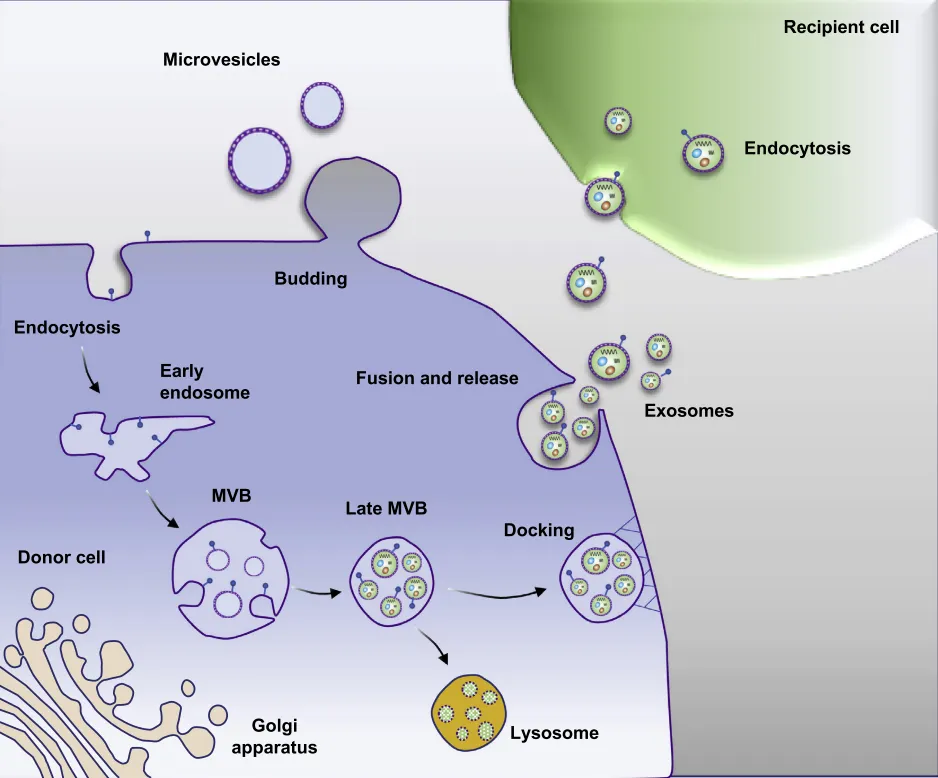
外泌体的蛋白质组成反映了它们源自哪种类型的细胞。不论在哪种类型的细胞或体液中,外泌体都含有相同的标记分子,如Alix、TSG101、SNARE、RAB GTPase和CD9、CD63、CD81等四次跨膜蛋白。除了特定的蛋白组成,外泌体还含有特殊的脂质。这些脂质包括胆固醇、神经酰胺和鞘磷脂,它们在外泌体的形成和分泌过程中都起到了重要作用。
Part.2 外泌体的提取方式
|
方法 |
技术介绍 |
优点 |
缺点 |
|
差速离心法 |
低速离心去除细胞碎片,高速离心去除大囊泡,超高速离心沉淀外泌体 |
无需对外泌体进行标 记,适用于处理大量样本 |
过程较耗时,且超高速离心可能造成外泌体结构破坏 |
|
密度梯度离心 |
将超速离心和蔗糖密度梯度离心相结合 |
可实现外泌体和非囊性颗粒的分离,获得的外泌体纯度较高 |
步骤繁琐 |
|
过滤法 |
通过离心将溶剂和小分子物质过滤到膜的另一侧,将外泌体截留在超滤膜上 |
操作简单,成本低,富集效率高 |
过膜时易变形,大颗粒蛋白污染严重,且由于过滤膜的粘附性,可能会造成外泌体的损失 |
|
免疫磁珠法 |
外泌体表面有许多标专蛋白(如CD9\CD63\CD81和ANNEXIN等),将抗体固定在磁珠等基质上,利用相应抗体与这些蛋白质间的特异性作用,即可实现对外泌体的特异性富集 |
外泌体完整性和纯度高,操作简单 |
成本较高,不适合处理大量样本
|
Part.3 外泌体鉴定方式
外泌体分离之后,我们一般是通过鉴定外泌体大小(NTA粒径分析)、形态(透射电镜)、表面标志物(免疫印迹)三个方面来进行。
01 外泌体大小——NTA粒径分析
纳米颗粒跟踪分析(Nanoparticle Tracking Analysis,NTA)即外泌体粒径分析技术的原理是对每个纳米颗粒的布朗运动进行追踪和分析,结合Stockes-Einstein方程式计算出其粒径和浓度。NTA技术样本处理简单,检测速度快,是鉴定外泌体表征的主要手段之一。通过经典微电泳技术和布朗运动对单个颗粒进行跟踪分析,结合分析软件ZetaView 8.04.02可以计算出每个颗粒的粒径和浓度。
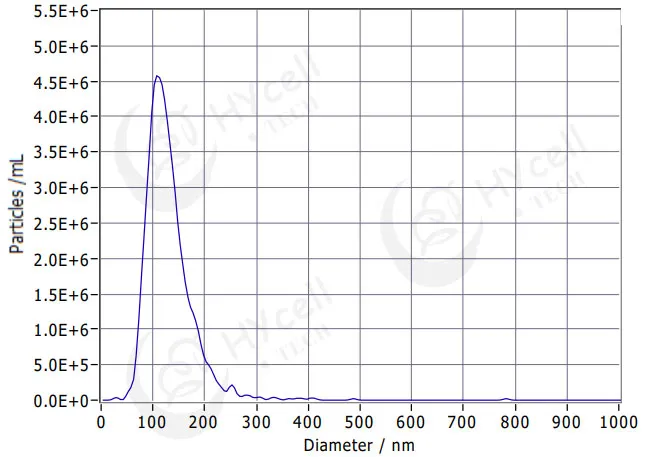
外泌体大小NTA粒径分析
02 外泌体形态——透射电镜
透射电子显微镜(Transmission Electron Microscope,简称TEM),可以看到在光学显微镜下无法看清的小于0.2um的细微结构,这些结构称为亚显微结构或超微结构。双层囊膜结构(亚显微结构)是外泌体重要标志之一,所以透射电镜作为外泌体表征检测方式之一,可以很好的拍出外泌体双层囊膜结构,用来观察外泌体形态。
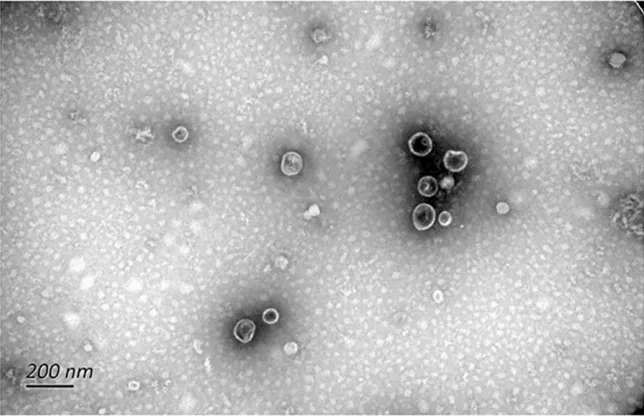
03 外泌体表面标志物——免疫印迹法
ISEV建议至少检测三类蛋白以表征细胞外囊泡,包括跨膜或GPI锚定蛋白(如CD63、CD9、CD81)、被囊括进去的胞质蛋白(如TSG101、HSP70、ALIX)和存在于其他胞内细胞器的阴性蛋白(如核蛋白Histone、 Lamin A,内质网蛋白calnexin,高尔基体蛋白GM130,线粒体蛋白cytochrome c,以及细胞骨架蛋白cytokeratin 18)。由于提取技术的限制,目前将小于200nm的囊泡统称之为小细胞外囊泡(sEV)。最常用的外泌体标志物是CD63、CD9、CD81以及TSG101、HSP70、HSP90、ALIX。
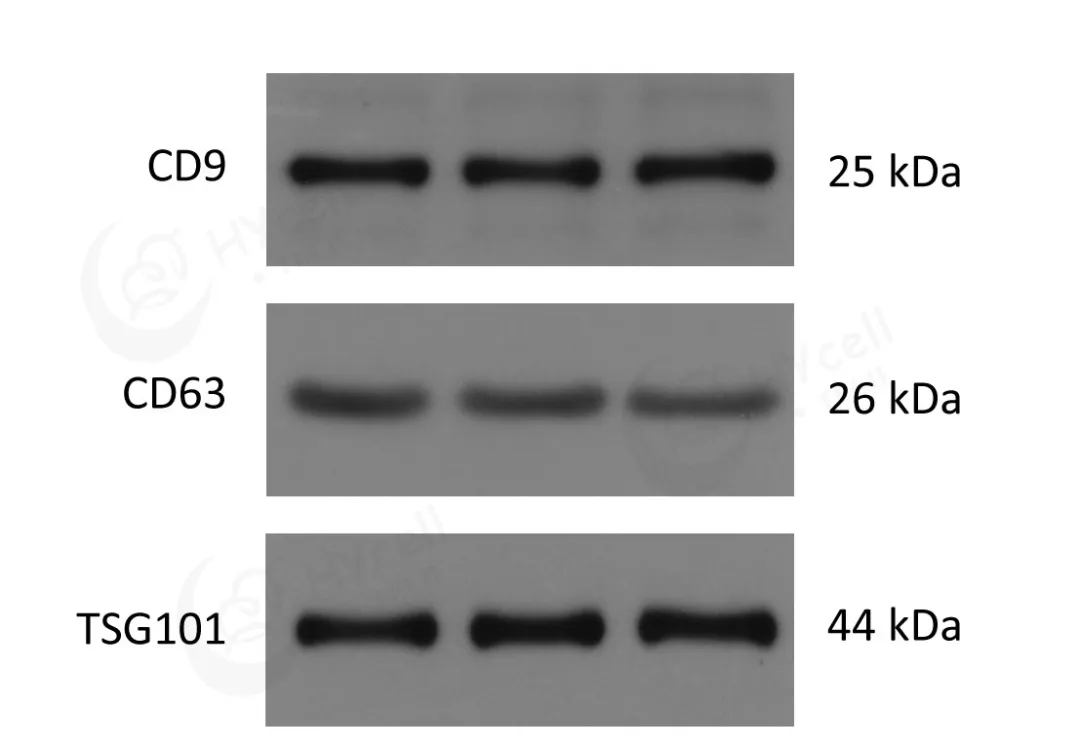
外泌体表面标志物免疫印迹
Part.4 外泌体在肿瘤液体活检中展现的潜力
当前,固体活检病理诊断是癌症治疗的黄金标准,但这种方法是侵入性的,有时候还无法执行。非侵入性的液体活检显现出了很大的优势,能进行个性化的诊断和治疗,结果也更准确。目前,外泌体已经在肿瘤的早期诊断及病情监测中展现出了很大的潜力。[5]。
- 肝癌:外泌体miR-21发现抑制肝癌细胞的细胞凋亡,调节肝细胞癌患者。Exosomal CEA和GPC-3等蛋白质,能够区分肝癌患者和健康者,可作为非侵入性癌症诊断的有前途的生物标志物[6]。
- 胰腺癌:外泌体miRNA-10b是胰腺癌研究公认的指标,它被广泛研究用于早期诊断胰腺导管腺癌(PDAC)。glypican-1(GPC1)特异性地富集于肿瘤细胞来源的外泌体上,富含GPC1的循环外泌体(GPC1+crExos)能绝对特异而敏感地在胰腺癌患者的血清中检测到,将早期和晚期胰腺癌患者与良性胰腺疾病患者和正常群体区分出来[7]。
- 结直肠癌:是最常见的恶性肿瘤之一。外泌体CircRNA与癌症的发生和发展有关。由于圆形结构,它提供了一个稳定的生物标志物对癌症的诊断。结直肠癌患者血清中外泌体CircRNA-0004771上调,可以区分I期和II期结直肠癌患者与其他良性肠道疾病,因此可以作为结直肠癌的潜在诊断标记物[8]。
Part.5 外泌体未来展望
外泌体肿瘤活检是一种非常有前景的癌症诊断和预后方法。外泌体在蛋白质组学分析中显示出对肿瘤发展有重要作用,其表面蛋白有助于了解外泌体的生物发生、分泌、蛋白质相互作用和靶向机制。癌症病变的特有蛋白可选择性富含在体液中的外泌体中,且已知癌症表面标记抗体可用于鉴定外泌体表面标记,提供肿瘤的生物学信息。
外泌体向病变细胞运送功能物质的特性展现出了它们作为治疗载体的潜能。与脂质体相比,外泌体的免疫清除率低。此外外泌体已被证实且具有良好的耐受性,无明显副作用[9]。新技术的进步使得外泌体蛋白或蛋白质组图谱不仅可为癌症诊断和预后提供线索,也为未来癌症治疗提供可能。
【参考文献】
1.Isaac R, Reis FCG, Ying W, Olefsky JM. Exosomes as mediators of intercellular crosstalk in metabolism. Cell Metab. 2021;33(9):1744-1762. doi:10.1016/j.cmet.2021.08.006.
2.Li X, Wang W, Chen J, et al. The potential role of exosomal miRNAs and membrane proteins in acute HIV-infected people. Front Immunol. 2022:13:939504.
3.Yu LL, Zhu J, Liu JX, Jiang F, Ni WK, Qu LS, Ni RZ, Lu CH, Xiao MB. A Comparison of Traditional and Novel Methods for the Separation of Exosomes from Human Samples. Biomed Res Int. 2018 Jul 26;2018:3634563.
4.Li J, Liu K, Liu Y, Xu Y, Zhang F, Yang H, et al. Exosomes mediate the cell-to-cell transmission of IFN-α-induced antiviral activity. Nat Immunol. 2013:14(8):793-803.
5.Zhou B, Xu K, Zheng X, et al. Application of exosomes as liquid biopsy in clinical diagnosis. Signal Transduct Target Ther. 2020;5(1):144. Published 2020 Aug 3. doi:10.1038/s41392-020-00258-9.
6.Joshi GK, Deitz-McElyea S, Liyanage T, Lawrence K, Mali S, Sardar R,et al. Label-free Nanoplasmonic-based short noncoding RNA sensingat Attomolar concentrations allows for quantitative and highly specificassay of MicroRNA-10b in biological fluids and circulating exosomes.ACS Nano. 2015;9:11075–89.
7.Melo, S., Luecke, L., Kahlert, C. et al. Glypican-1 identifies cancer exosomes and detects early pancreatic cancer. Nature .2015:523(7559): 177-182.13. Li S, Zhao Y, Chen W, Yin L, Zhu J, Zhang H, et al. Exosomal ephrinA2 derived from serum as a potential biomarker for prostate cancer. J Cancer. 2018:9:2659–65.
8.Han L, Shi W-J, Xie Y-B, Zhang Z-G. Diagnostic value of four serum exosome microRNAs panel for the detection of colorectal cancer. World J Gastrointest Oncol. 2021:13:970–9.
9.Johnson V, Vasu S, Kumar US, Kumar M. Surface-Engineered Extracellular Vesicles in Cancer Immunotherapy. Cancers (Basel). 2023;15(10):2838. Published 2023 May 19. doi:10.3390/cancers15102838
新闻推荐
在线咨询
Online consultation

关注微信公众号


